
[엠디저널]1907년 알로이 알츠하이머가 “알츠하이머”란 질병을 발견한 지 100여년이 지난 2001년에서야 비로소 Aβ 생성을 억제하는 신약에 대한 임상시험이 시작되었으며, 이후 지금까지 관련된 임상시험은 대부분 실패했으며, 현재까지도 사용 승인허가는 물론 개발된 신약도 없다.
1907년 알로이 알츠하이머가 “알츠하이머”란 질병을 발견한 지 100여년이 지난 2001년에서야 비로소 Aβ 생성을 억제하는 신약에 대한 임상시험이 시작되었다. 이후 알츠하이머 치료제 중 가장 마지막에 개발된 ‘나멘다’가 2003년 FDA로부터 승인받은 후 15여년이 지난 지금까지 관련된 임상시험은 대부분 실패했으며, 현재까지도 사용 승인허가는 물론 개발된 신약도 없다. 2002년부터 2012년 사이 알츠하이머 치료제 후보물질 244개에 대한 413건의 임상시험 데이터베이스를 분석한 결과 임상 단계별 실패율을 보면 2상 진입 72% 실패, 3상 진입 92% 실패, 허가 99.6%실패로 최종 허가 성공률은 1% 미만이다.
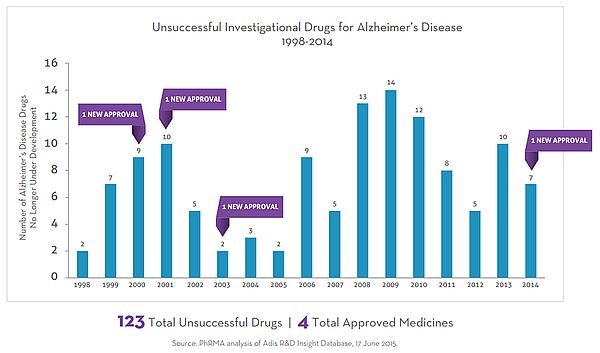
미국 제약협회에 따르면 1998년부터 2014년까지 실패한 알츠하이머 파이프라인 수는 123건인 반면, 신약 허가 건수는 1996년 donepezil이후로 4건에 불과하다(그림 1).
최근 알츠하이머에 걸린 노인의 사망위험이 8배 높아진다는 연구가 진행되었고, 전체 신약 개발 임상 2상, 3상 실패율(2006~2015년)이 각각 69%, 42%인 것을 볼 때 알츠하이머 신약 개발이 얼마나 어려운지 알 수 있다.
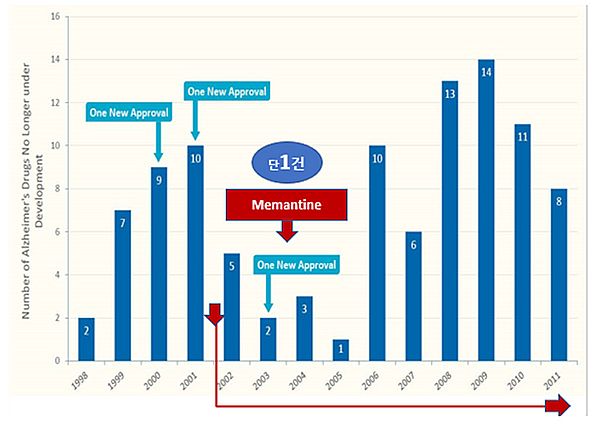
또한 2002~2012년 사이에 개발된 알츠하이머 치료 신약 413개의 임상시험 자료를 조사한 결과 FDA의 품목허가를 받은 경우는 단 1건에 불과했다(그림 2).
① 바피뉴주맙(Bapineuzumab) 실패(β-아밀로이드 인식 단일클론항체)
② 솔라네주맙(Solanezumab) 실패(β-아밀로이드 단백제거단일클론항체)
③ 베루베세스타트(Verbecestat) 실패(BACEI)
④ 아타바세스타트(Atabacestat /JNJ-54861911) 실패(BACEI)
⑤ 세마가세스타트(Semagacestat, LY450139) 실패(GSI)
⑥ 아바가세스타트(Avagacestat, BMS-708163) 실패(GSI)
⑦ 감마가드(Gammagard®) 실패(Immunoglobulin based)
⑧ 피오글리타존(Pioglitazone, Actos®) 실패(뇌의 항염증)
알츠하이머 치료제 개발 실패의 가장 큰 이유는 인간의 뇌와 마우스 뇌는 근원적으로 다르다는 점이다.
인간의 뇌와 마우스의 뇌는 근본적으로 다르다. 측두엽부터 시작하여 점차 대뇌기능을 파괴시키는 알츠하이머에 대한 두려움이 큰 것은 그 질병의 기전에 대한 정확한 원인이 밝혀져 있지 않기 때문이다.
알츠하이머의 기전을 알기 어려운 큰 이유는 사람의 뇌에는 870억 개의 신경세포가 있고 각각의 세포들은 1000개 이상의 시냅스를 가지고 있기 때문에 이 안에 담긴 정보의 양이 우리가 상상하는 범주를 벗어난다는 것이다. 그래서 인간의 뇌를 ‘소우주’라고도 표현한다. 뇌의 복잡성에 따른 정보의 거대함은 인간의 계산 능력을 뛰어넘는다.
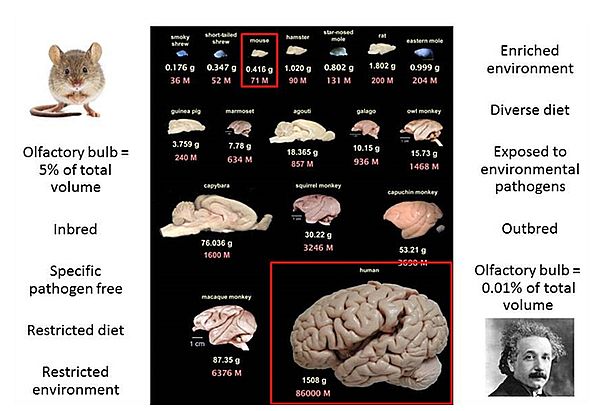
알츠하이머라는 거대한 산을 넘기 위해서 질병으로 진행될 수밖에 없는 뇌의 구조와 그 신비로운 역할에 대해서 아직도 얼마나 더 많은 연구를 해야 할 지 미지수이다. 알츠하이머의 치료제에 대한 개발이 늦어지는 이유도 동물실험으로 해결할 수 없는 인간의 뇌의 신비한 기능과 살아있는 뇌를 구해서 실험할 수 없다는 많은 제약이 따른다는 점이다. 한 가지 기억해야 할 중요한 사실은 실험용 쥐의 뇌와 인간의 뇌는 구조적으로 완전히 다르다는 것이다(그림 3). 따라서 동물실험에서 성공한 제제가 인간의 뇌에서 같은 효과를 내지 못하는 점에 대해 의문을 제기할 필요가 없다.
알츠하이머 치료제 개발 실패의 두 번째 이유는 치료 목표를 뇌 내 Aβ만을 타켓으로 설정하였다는 점이다.
알츠하이머 치료제 개발을 위한 임상시험이 99% 이상 실패한 이유는 Aβ 단백질 제거에만 초점을 맞췄기 때문이다. 사망한 알츠하이머 환자의 뇌에서는 반드시 Aβ 플라그가 발견되었기 때문에 아밀로이드 가설을 정설로 인정하였다. 한 건 당 무려 5,000만 달러 이상의 비용이 든 임상시험의 결과는 Aβ만 막아내면 알츠하이머를 치료할 수 있을 것이라는 막연한 기대를 무너뜨리게 되었다.
앞에서 언급한 바와 같이 지금까지의 추정과는 달리 알츠하이머를 유발한다고 믿었던 Aβ는 뇌가 스스로를 보호하기 위하여 방어하는 과정에서 합성되는 부산물이라는 사실을 고려할 때 Aβ만을 제거하려는 노력은 무의미한 일이었을 수도 있다.
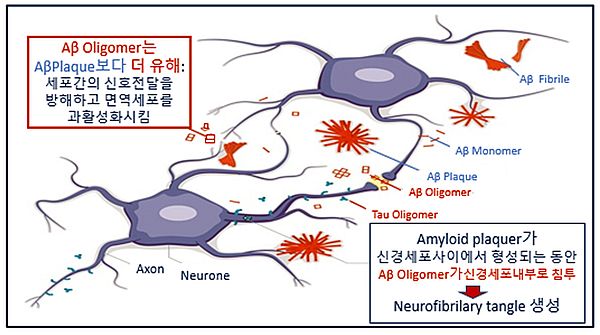
알츠하이머 환자의 뇌에서 Aβ를 제거하였더니 오히려 알츠하이머 증세가 더 악화되었다는 보고도 있다(그림 4). 이는 알츠하이머가 부분적으로 Aβ 단백질의 과다 생성과 그에 상응하는 클리어런스가 부족해서 발생한다는 사실을 입증해 주는 내용으로 Aβ 단백질 중 가장 독성이 강한 Aβ oligomer는 Aβ plaque에 응집되어 제거될 수 있으며, Aβ를 제거하였을 경우 오히려 남아 있는 독성이 강한 Aβ oligomer에 의해 신경염증(neuroinflammation)이 악화될 수 있음을 시사한다.
알츠하이머 치료제 개발 실패의 세 번째 이유는 뇌세포라는 실험의 한계점이다.
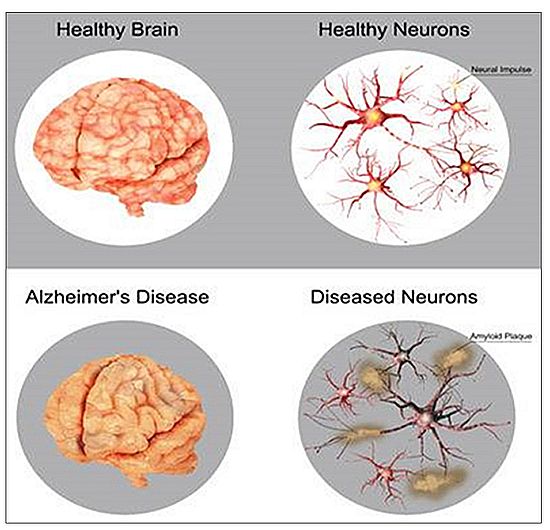
알츠하이머 치료제의 신약 개발이 더디고 힘든 이유는 암에 걸린 환자는 환자 몸에서 떼어낸 암세포를 배양해서 연구가 가능하지만, 알츠하이머의 환자의 경우 살아있는 뇌세포를 떼어 내어 뉴런을 분리해 연구할 수는 없다는 생체실험의 한계에서 온 당연한 결과일 수 있다(그림 5).
따라서 알츠하이머 환자가 사망할 때까지 기다려서 뇌세포를 채취할 수밖에 없고 이때는 이미 알츠하이머가 심각한 상황으로 진행이 된 이후이기 때문에 질병의 진행상황에 대해 마우스의 뇌세포가 아닌 인간의 뇌를 가지고 실험할 기회가 부족한 상황에서 얻어진 결과물이라고 해석될 수 있겠다.
알츠하이머 치료제 개발 실패의 네 번째 이유는 치료대상 선정의 문제점이다. 실패율이 높은 이유는 너무 질병이 진행된 환자들을 대상으로 했기 떄문이다.
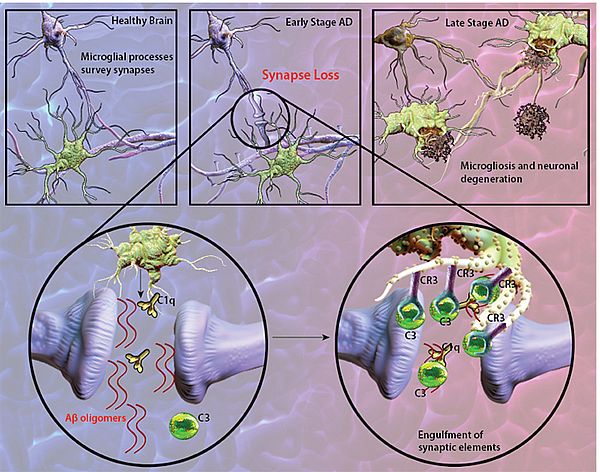
알츠하이머가 신경세포의 손상에서 오는 인지능력장애라는 질병의 특성을 고려할 때 질병이 진행되어 이미 신경세포가 너무 많이 사멸된 환자를 대상으로 시험을 했다는 점을 문제점으로 꼽을 수 있다(그림 6). 최근 임상3상에서 실패한 솔라네주맙과 같은 Aβ 단클론항체 면역제제들이 새롭게 MCI와 Pro-AD 환자를 대상으로 임상4상에 들어갔다는 점을 그 예로 들 수 있다.
알츠하이머 치료제 개발이 더딘 이유는 임상시험에서의 실패율이 높기 때문이다.
알츠하이머, 단 한 가지 질병만을 5년간 발병을 지연시킬 수 있다면 2020년에서 2035년 사이 15년 동안 약 1천억 파운드(약 14억 달러)의 의료비가 절감될 것으로 추정한다. 치료제 개발이 지연되면서 알츠하이머로 인한 사망자 수도 늘고 있다. 미국의 경우 2013년 뇌졸중과 심장질환, 전립선암으로 인한 사망건수가 2000년에 비해 각각 23%, 14%, 11% 감소했지만 같은 기간 알츠하이머로 인한 사망건수는 71% 증가했다. 3억2,500만 명의 미국인 중 4,500만 명이 알츠하이머로 목숨을 잃고 있다. 이와 같은 결과는 언뜻 보기에 알츠하이머가 다른 질환과 비교해 임상연구나 신약개발에 기울인 노력이 미흡하다고 보여 질 수도 있다.
하지만 알츠하이머 치료제 개발이 더딘 이유는 임상시험에서의 실패율이 높기 때문이다. 알츠하이머 치료제로 400건이 넘는 임상시험과 수십억 달러가 투입되었지만 지난 16년 동안 알츠하이머에 대한 신약이 승인되지 않았다. 그동안 수많은 글로벌 거대 제약사들이 알츠하이머 치료제 개발에 뛰어들었으나 대부분 마지막 단계인 임상3상에서 실패했다. 알츠하이머 의약품 개발이 모든 신약개발 중 가장 높은 실패율을 보이는 것으로 밝혀짐에 따라 알츠하이머 치료제 개발 파이프라인은 큰 실패를 특징으로 하는 것처럼 보여 진다.
알츠하이머 자체가 노인의 사망 위험을 1.7배에서 최대 6.3배까지 높인다는 사실은 국내외 다양한 연구를 통해 이미 입증되었으며 이는 이미 알츠하이머를 앓고 있던 노인보다도 최근 알츠하이머가 생긴 경우에 사망 위험이 더 높아지고, 그 수준도 약 3배 이상이나 된다는 것을 의미한다. 이미 알츠하이머를 앓고 있는 환자보다 새롭게 알츠하이머를 앓는 환자의 사망률이 높은 이유는 늦게 발병한 알츠하이머의 경우에 신경의 손실이 더 급격하게 나타나기 때문이라고 알려졌다. 이미 앓고 있던 환자는 지속적으로 치료를 받아오고 있으며 질병에 도움이 되는 일을 무엇이라도 해 왔을 것으로 추정하여 신경세포의 가소성이 지속적으로 유지되어 왔을 것으로 이해할 수 있다.
한국인 사망률 1위 질환은 암이지만 암만큼이나 두려운 병을 꼽으라면 알츠하이머를 빼놓을 수 없다. 알츠하이머에 대한 근본원인을 찾지 못하고 있으며, 그로 인하여 알츠하이머 신약 개발에 대한 임상 실패율은 무려 99.6%에 달한다. 따라서 알츠하이머의 가장 근본적인 치료법은 예방이다.
한국인 사망률 1위 질환은 암이지만 암만큼이나 두려운 병을 꼽으라면 알츠하이머를 빼놓을 수 없다. 어느 한편으로는 암보다 더 걸리기 싫은 병 1위로 치매를 꼽는 노인들도 꽤 많다. 알츠하이머의 경우 발병하면 환자 자신은 물론 가족까지도 고통과 시련의 긴 어두운 터널을 함께 걸어가야 한다. 특히 고령의 노인의 경우 노화와 함께 닥치는 우울증이나 불안증과 더불어 알츠하이머에 걸릴 확률이 높아지고, 때문에 그만큼 주위에서 알츠하이머에 걸린 환자를 자주 볼 수 있다는 것은 이미 알츠하이머가 우리들의 생활 속에 깊숙이 들어와 있다는 것을 느끼게 해준다. 더욱이 인구 노령화로 인해 알츠하이머 환자는 매년 빠른 속도로 증가하고 있다. 보건복지부 중앙치매센터에 따르면 우리나라 치매 환자 수는 69만 명으로 추정되며, 2024년에는 100만 명을 훌쩍 넘고 2050년에는 271만 명을 예상하고 있다.
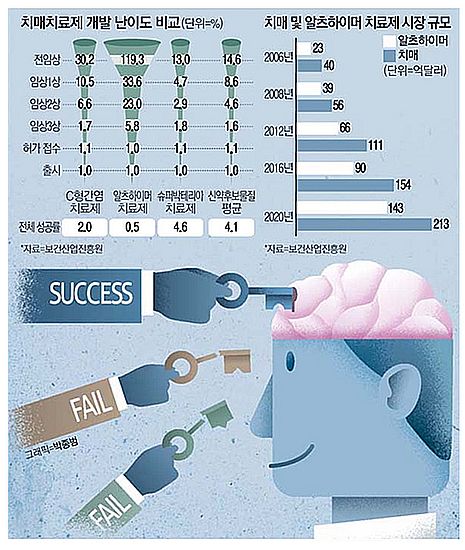
여전히 알츠하이머에 대한 근본원인을 찾지 못하고 있으며, 그로 인하여 알츠하이머 신약 개발에 대한 임상 실패율은 무려 99.6%에 달한다(그림 7). 현재 치매 치료제 개발 실패율이 ‘99%’를 웃돌고 있지만 ‘1%’의 가능성을 향한 제약계의 도전은 ‘현재 진행형’이다. 환자군 또는 치료 용량 등을 변경해 새로운 임상시험을 진행하고 있으며, 패러다임 전환을 통한 알츠하이머 정복 시도도 이어지고 있다. 그렇다고 이 무서운 알츠하이머의 정확한 기전을 알고 치료제가 개발되기까지 무방비상태로 손을 놓고 기다릴 수만은 없는 노릇이다.

알츠하이머의 가장 근본적인 치료법은 예방이다. 이를 지키기 위해 스트레스로부터 자유로워 질 수 있는 건강한 뇌세포를 간직할 수 있는 바른 섭생을 지킬 수 있어야하고 뇌 건강을 위한 바른 영양소(글리코영양소)의 선택도 필수사항이다.

